疾患プロテオミクス研究分野
次世代酵素学研究領域
質量分析を基盤としたプロテオミクス・メタボロミクス研究とその疾患研究への応用
准教授 真板 宣夫
nmaita@tokushima-u.ac.jp
1994年 東京大学工学部反応工学科 卒業
2002年 奈良先端科学技術大学院大学博士後期課程修了、博士(バイオサイエンス)取得
農業生物資源研究所、NEDOフェロー、九州大学で博士研究員を経て
2007年 徳島大学疾患酵素学研究センター 助教
2010年 徳島大学疾患酵素学研究センター 准教授
2016年 徳島大学先端酵素学研究所 准教授
研究概要
本分野では、タンパク質立体構造解析による構造機能相関、構造情報に基づく薬剤設計、タンパク質結晶を用いたナノ技術開発など、次世代のライフサイエンス研究を推進しています。
疾患関連タンパク質の結晶構造解析
タンパク質の原子分解能での立体構造解析は、タンパク質の機能、反応機構、相互作用などを明らかにすることが出来ます。疾患の原因となるタンパク質であれば、詳細な分子モデルから疾患の原因を明らかにすることが出来ます。遺伝子的な病気である場合、その変異箇所からタンパク質の機能がどのように失われているか理解することが出来、それによる治療法や薬も開発することが可能となります。
リソソーム病はリソソームで働く様々な分解酵素の先天的な機能不全により重篤な症状を呈します。これらのタンパク質の立体構造を明らかにし、患者で見つかっている変異を構造に当てはめることでその重篤度合いや、治療法を変異箇所ごとに対応することが出来るようになります。当分野ではHurler病(I型ムコ多糖症)の責任遺伝子産物であるα-イズロニダーゼの結晶構造を解明し、変異と疾患の関係を明らかにすることが出来ました。それ以外に、この酵素が327番目のアスパラギンに結合している糖鎖が活性に深く関与していることが判りました(Maita et al., 2013)。その他、GM2ガングリオシドーシスの遺伝子治療を目指して開発した変異体の結晶構造解析(Kitakaze et al., 2016)など、リソソーム病関連の結晶構造解析を行っています。
レトロトランスポゾンの構造解析
ヒトゲノム中の97%は遺伝子でない部分、所謂Junk DNAと呼ばれる領域になります。このうち“動く遺伝子”(=トランスポゾン)が大多数を占めていますが、実にヒトゲノム中の17%がLINE1というレトロトランスポゾン由来の配列であることがわかっています。LINE1は現在でも一部がゲノム中を転移しています。転移箇所によっては新たな病気の原因となる一方、新規機能獲得の原動力となることも知られています。LINE型レトロトランスポゾンの構造解析は全く進んでおらず、難解析性タンパク質の一つです。当分野では高発現なLINEを使って、結晶構造解析またはクライオ電子顕微鏡での構造解析を目指しています。
タンパク質結晶を足場とした機能性マテリアルの開発
近年、材料化学分野では金属有機構造体(MOF:Metal Organic Frameworks)によるナノマテリアルの開発が盛んに行われています。MOFのひとつの応用例として、内部に酵素を係留させた機能性ナノマテリアルの開発がありますが、タンパク質を結合させる方法がまだ不十分で実用化には多くの課題が残っています。タンパク質結晶の中には溶媒領域が極めて多く、多孔性のものがいくつかあります。私はこれらを多孔性マテリアルとして捉え、新しい機能性マテリアルの開発を行っています。
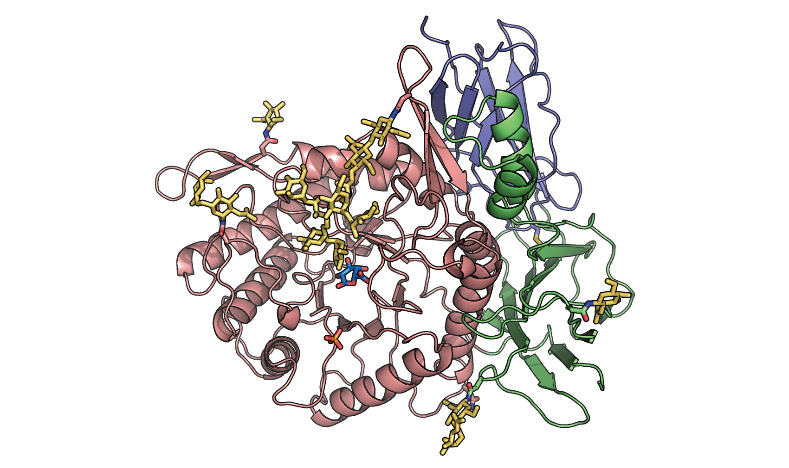
図1.Hurler病の原因となるα-イズロニダーゼの結晶構造
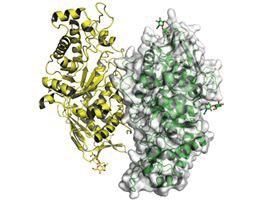
図2.GM2ガングリオシドーシスの治療を目的とした改変HexB
最近の主要論文
- Kitakaze K, Mizutani Y, Sugiyama E, Tasaki C, Tsuji D, Maita N, Hirokawa T, Asanuma D, Kamiya M, Sato K, Setou M, Urano Y, Togawa T, Otaka A, Sakuraba H & Itoh K.
Protease-resistant modified human β-hexosaminidase B ameliorates symptoms in GM2 gangliosidosis model.
J Clin Invest, 126:1691-1703 (2016).
- Ohno A, Ochi A, Maita N, Ueji T, Bando A, Nakao A, Hirasaka K, Abe T, Teshima-Kondo S, Nemoto H, Okumura Y, Higashibata A, Yano S, Tochio H & Nikawa T.
Structural analysis of the TKB domain of ubiquitin ligase Cbl-b complexed with its small inhibitory peptide, Cblin.
Arch Biochem Biophys, 594:1-7 (2016).
- Sugawara A, Maita N, Gouda H, Yamamoto T, Hirose T, Kimura S, Saito Y, Nakano H, Kasai T, Nakano H, Shiomi K, Hirono S, Watanabe T, Taniguchi H, Ōmura S & Sunazuka T.
Creation of customised bioactivity within a 14-membered macrolide scaffold; design, synthesis, and biological evaluation using a family-18 chitinase.
J Med Chem, 58:4984-4997 (2015).
- Saito S, Ohno K, Maita N & Sakuraba H.
Structural and clinical implications of amino acid substitutions in α-L-iduronidase: Insight into the basis of mucopolysaccharidosis type I.
Mol Genet Metab, 111:107-112 (2014).
- Hirose T, Maita N, Gouda H, Koseki J, Yamamoto T, Sugawara A, Nakano H, Hirono S, Shiomi K, Watanabe T, Taniguchi H, Sharpless KB, Ōmura S & Sunazuka T.
Observation of the controlled assembly of preclick components in the in situ click chemistry generation of a chitinase inhibitor.
Proc Natl Acad Sci USA, 110:15892-15897 (2013).
- Maita N, Tsukimura T, Taniguchi T, Saito S, Ohno K, Taniguchi H & Sakuraba H.
Human α-L-iduronidase uses its own N-glycan as a substrate-binding and catalytic module.
Proc Natl Acad Sci USA, 110:14628-14633 (2013).
スタッフ
准教授:真板 宣夫
2002年 奈良先端科学技術大学院大学博士後期課程修了、博士(バイオサイエンス)取得
農業生物資源研究所、NEDOフェロー、九州大学で博士研究員を経て
2007年 徳島大学疾患酵素学研究センター 助教
2010年 現職
助教:谷口 貴子
2003年 徳島大学工学部 卒業
2009年 徳島大学医科学教育部博士課程 修了
2009年 徳島大学疾患酵素学研究センター 学術研究員(特任助教)
2014年 現職
助教:平岡 陽子
2002年 岐阜薬科大学 卒業
2003年 岐阜薬科大学 薬剤学教室 助手
病院勤務を経て
2015年 徳島大学 疾患酵素学研究センター 疾患プロテオミクス研究部門 学術研究員
2016年 現職












