ゲノム医科学分野

2000年 九州大学大学院農学研究科博士課程修了 農学博士
2010年 徳島大学疾患ゲノム研究センター 特任助教
2013年 徳島大学疾患プロテオゲノム研究センター 助教
2016年 徳島大学先端酵素学研究所 講師
2020年 徳島大学先端酵素学研究所 准教授(現職)
2024年 医薬基盤・健康・栄養研究所 主任研究員(現職)
研究概要
本邦において死亡原因の第1位であるがんは、ゲノム(エピゲノム)の異常が蓄積して、多段階に発症・進展しますが、蓄積した異常がどのように関わり合い、異常形質を現すかは、未だ十分にはわかっていません。
当研究室では、包括的ゲノム解析を通じて「がん関連分子」を多数同定しており、それらの機能解析から、がんの発症・進展機構の解明および新規診断・治療法の開発から個別化医療の推進を目指しています。
がん特異的足場タンパク質BIG3の機能解析と創薬開発研究
新規がん特異的足場タンパク質BIG3(Brefeldin A-Inhibited Guanine nucleotide-exchange protein 3)の機能解析を進めています。BIG3は、乳がん細胞にてPP1CαとPKAと複合体を形成し、がん抑制因子PHB2(Prohibitin2)の抑制活性を喪失させて、乳がん細胞におけるERαの恒常的な活性化に関与することを明らかにしました。さらに、BIG3-PHB2相互作用阻害ペプチド(ERAP)を開発し、PHB2の抑制機能を活用する治療戦略を確立しています。現在、臨床応用に向けた開発研究に取り組んでいます。
トリプルネガティブ乳がんの発症機構の解明と新規治療薬の開発
包括的ゲノム解析により、予後不良で、治療標的の存在しないホルモン受容体(エストロゲン受容体・プロゲステロン受容体)陰性・HER2陰性のトリプルネガティブ乳がん(TNBC)の発症・進展に関連する分子を多数同定しており、それらの機能解析によるTNBCの発症、進展の分子機構の解明と創薬研究を進めています。
乳がん細胞におけるO型糖鎖修飾を介したがん微小環境適応機構の解明と新規治療薬開発
乳がん特異的O-結合型糖転移酵素に着目し、それらの機能解析を通じて、O-結合型糖鎖修飾が乳がん細胞のがん微小環境への適応と増殖、進展に重要な役割を果たすことを明らかにしています。また、これら糖転移酵素を標的とした新規乳がん治療薬の開発を目指しています。
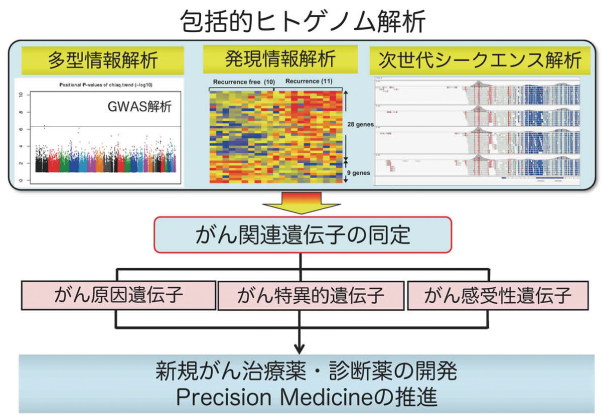
当研究室の研究戦略
発現情報解析・体系的多型情報解析・次世代シーケンス解析などの包括的ゲノム解析を通じて、がんの発症進展機構の解明および個別化医療の推進目指しています。
最近の主要論文
- Toki S, Yoshimaru T, Matsushita Y, Aihara H, Ono M, Tsuneyama K, Sairyo K, Katagiri T*. The survival and proliferation of osteosarcoma cells are dependent on the mitochondrial BIG3-PHB2 complex formation. Cancer Sci 112: 4208-4219 (2021)
- Yoshimaru T, Nakamura Y, Katagiri T*. Functional genomics for breast cancer drug target discovery Journal of Human Genetics, 66:927-935 (2021)
- Kimura R, Yoshimaru T, Matsushita Y, Matsuo T, Ono M, Park JH, Sasa M, Miyoshi Y, Nakamura Y, Katagiri T*. The GALNT6-LGALS3BP axis promotes breast cancer cell growth. Int J Oncol 56: 581-595 (2020).
- Daizumoto K, Yoshimaru T, Matsushita Y, Fukawa T, Uehara H, Ono M, Komatsu M, Kanayama H, Katagiri T*. A DDX31/mutant-p53/EGFR axis promotes multistep progression of muscle invasive bladder cancer. Cancer Res 78: 2233-2247 (2018).
- Yoshimaru T*, Aihara K, Komatsu M, Matsushita Y, Okazaki Y, Toyokuni S, Honda J, Sasa M, Miyoshi Y, Otaka A, Katagiri T*. Stapled BIG3 helical peptide ERAP extends potent antitumor activity for breast cancer therapeutics. Sci Rep 7: 1821 (2017)
- Yoshimaru T, Ono M, Bando Y, Chen YA, Mizuguchi K, Shima H, Komatsu M, Imoto I, Izumi K, Honda J, Miyoshi Y, Sasa M, Katagiri T*. A-kinase anchoring protein BIG3 coordinates oestrogen signaling in breast cancer cells. Nat Commun 8: 15427 (2017)
- Yoshimaru T, Komatsu M, Matsuo T, Chen YA, Murakami Y, Mizuguchi K, Mizohata E, Inoue T, Akiyama M, Miyoshi Y, Sasa M, Nakamura Y, Katagiri T*. Targeting BIG3-PHB2 interaction to overcome tamoxifen resistance in breast cancer cells. Nat Commun 4: 2443 (2013)








