2011年 金沢大学大学院医学系研究科修了 博士(医学)
2011年 京都大学大学院医学研究科 GCOE特定研究員
2013年 日本学術振興会特別研究員(PD)
2014年 藤井節郎記念医科学センター 助教
2019年 藤井節郎記念医科学センター 講師
2023年 現職
2020年 現職
2020年 現職
2020年 現職
2020年 現職


サイト内検索

1996年 東京大学大学院理学系研究科 生物化学専攻修了 博士(理学)
1996年 愛知県がんセンター研究所生化学部 研究員
2000年 東京大学大学院医学系研究科神経生物学教室 助手
2002年 東京大学医科学研究所細胞ゲノム動態解析寄付研究部門 助手(後に助教)相当
2008年 徳島大学疾患酵素学研究センター疾患プロテオミクス研究部門 准教授
2014年 徳島大学藤井節郎記念医科学センター細胞情報学分野 教授
2016年 徳島大学先端酵素学研究所 教授
私たちの研究室では、タンパク質間相互作用や翻訳後修飾による様々な細胞内シグナル伝達系の制御機構の解明を目指しています。このために、高性能質量分析計を駆使した最先端のプロテオーム解析をはじめ、相互作用解析やイメージングなどの種々の技術を開発・導入しています。徳島大学にオープンラボ方式で新設された藤井節郎記念医科学センターにおいて、多くの共同研究者の協力を得て、現在は特に疾患の原因となる複数のシグナル因子の生理・病理機能の解明を進めています。
生体内において多くのタンパク質は他のタンパク質とダイナミックに相互作用して複合体を形成することで機能しています。またタンパク質の多くは生体内でリン酸化・ユビキチン化・アセチル化などの多様な翻訳後修飾を受けることでその機能が調節されています。このようなタンパク質の相互作用や翻訳後修飾を介した様々な細胞内シグナル伝達の分子機構を明らかにすることは、多彩な生命現象の根幹を明らかにする上で重要です。私たちは生体内でのタンパク質間相互作用や翻訳後修飾を網羅的に同定・定量するために、最先端の各種プロテオーム解析法を開発・導入しています。そして同定された興味深いシグナル因子の生理・病理機能を様々な相互作用解析やイメージング技術などを用いて解明することを目標としています。
近年、単一オルガネラ膜上に異なる機能領域が存在することや、異なるオルガネラ同士が結合して膜接触領域を形成することが明らかとなり、膜環境の多様性に注目が集まっています。私たちは最近、自然免疫分子STINGのオルガネラ間移行とシグナル活性化を制御する特殊な小胞体-ゴルジ体膜接触領域を発見しました。このような膜の微小空間がダイナミックに形成される仕組みやその生理的意義を明らかにすることを目指し、時空間プロテオーム解析やリピドーム解析、超解像イメージング技術などを駆使して新しい膜構成要素の同定を進めています。これらの研究によって、オルガネラ膜の形成異常に起因する疾患の発症機構の解明につなげていきたいと考えています。
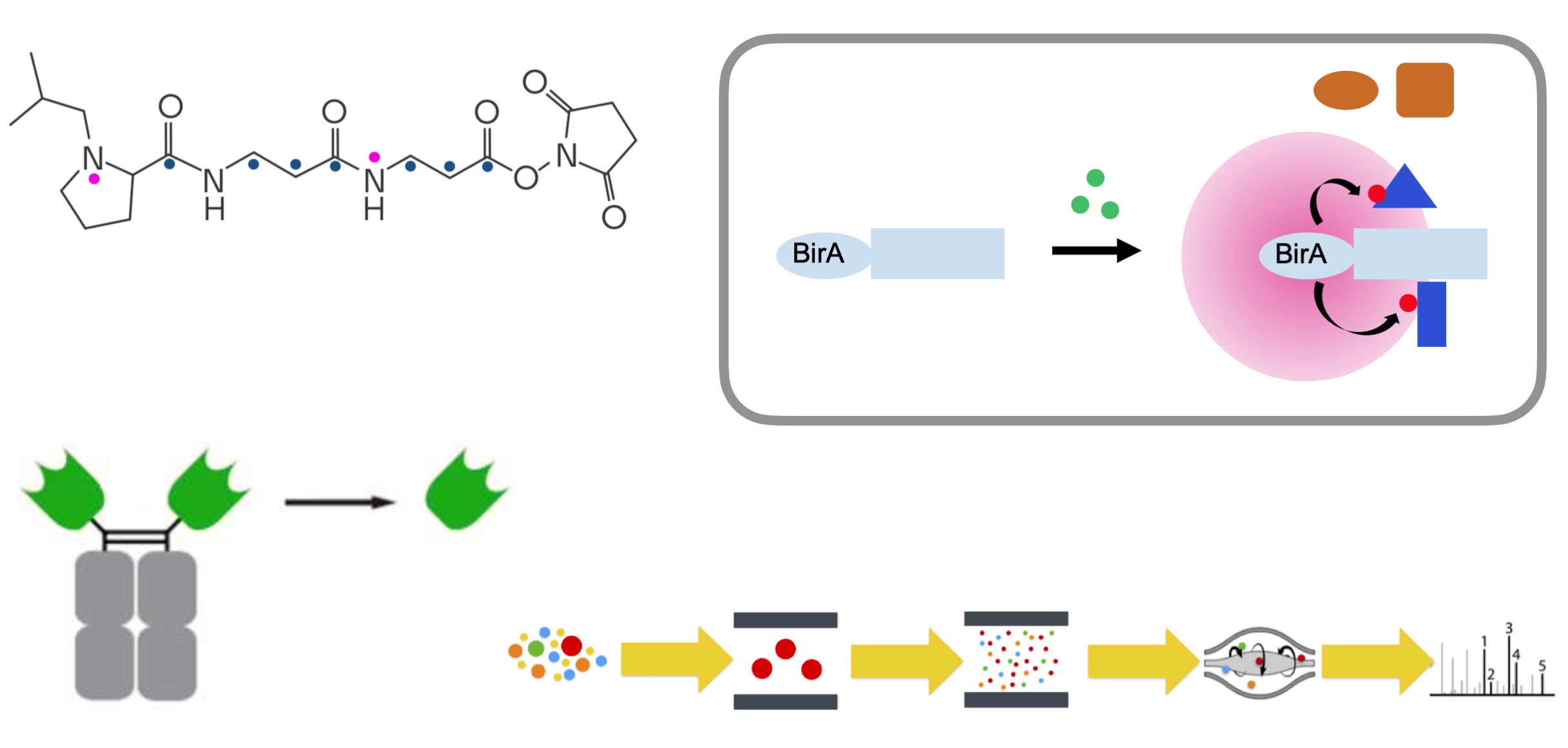
最先端の様々なプロテオーム解析法を開発・導入することにより、細胞内における多彩なシグナル伝達系の制御機構の解明を進めています。左上:TMT (tandem mass tag)標識法による多検体間での大規模比較定量、右上:BioID(近接依存性ビオチン化同定法)による生細胞内相互作用タンパク質の同定、左下:アルパカ由来nanobodyを用いたIP-MS(免疫沈降-質量分析)による相互作用因子と翻訳後修飾の同定、右下:PRM (parallel reaction monitoring)法による標的ペプチドの精密定量。
Copyright©2019 Institute of Advanced Medical Sciences, Tokushima University