2020年 大阪大学大学院生命機能研究科 博士後期課程修了 博士(理学)
2020年 川崎医科大学 医学部 助教
2024年 徳島大学先端酵素学研究所 助教


サイト内検索

2009年 京都大学大学院生命科学研究科 博士後期課程修了 博士(生命科学)
2009年 京都府立医科大学大学院医学研究科 助教
2012年 国立循環器病研究センター研究所 上級研究員
2017年 Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC) USIAS fellow
2020年 国立循環器病研究センター研究所 上級研究員
2022年 国立循環器病研究センター研究所 室長
2023年 徳島大学先端酵素学研究所 准教授
細胞内外で生じる「力」の作用は個体の形づくりに不可欠です。力の働きがないと、例えば骨は脆くなり、筋肉は萎縮し、心臓や血管は管腔が正確に形づくられません。ただし、力が大事であることが現象としてわかっていても、力による生物学的機構(いわゆるメカノバイオロジー)の仕組みについては未だに理解がすすんでいません。私たちは発生生物学、生物物理学、細胞生物学などの分野を横断して進めてきたこれまでの研究を軸にして、ユニークなアプローチを付加することで、この謎を解き明かしたいと考えています。
生体力学シグナル分野は2023年7月よりスタートしました。現在、国内外の研究者と積極的に共同研究をすすめています。新しいチームに参加していただける方、質問がある方、どなたでも連絡をお待ちしています。
我々の身体は細胞が受け取る情報の違いに起因して、異なる特徴をもつ細胞集団を構成し、機能的組織を適切に形づくります。私たちはとくに「心臓の形づくり」に興味をもち、力学作用の理解を目指しています。研究対象として小型魚類であるゼブラフィッシュの初期胚を用い、生体イメージング解析から心臓を形づくる過程を捉えます。
これまでの研究から、時空間特異的かつ直接的な力学応答シグナルを見出し、心管腔の弁形成に関わることを明らかにしてきました。一方で、心臓は管腔形成期より継続的に拍動しています。力が恒常的に生じる心管腔内で、生体はどのように力学応答を適切に調節するのでしょうか?私たちは心臓形成期における力学応答シグナルに着目し、秩序立った血流循環のために働く心臓管腔形成機序の疑問を解き明かします。特にゼブラフィッシュ胚体内で生じる様々な力の特性(血圧、血流、伸展、収縮、etc.)を切り分けて定量的に計測することを試み、管腔形成に関わる物理情報と生体シグナル応答の関係性を正しく評価します。そしてどのような力覚センサーを介するのか、また発生過程にとどまらず心疾患病態との関連に至るまで、作動原理の全容解明に取り組みます。
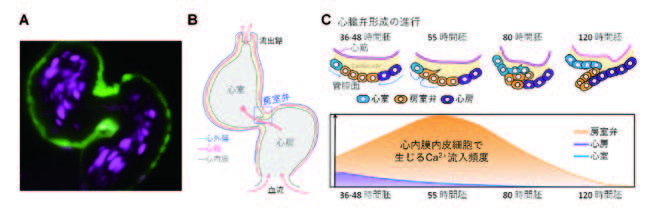
図1.ゼブラフィッシュ心臓管腔形成と力学応答シグナル(心内膜Ca2+流入)
A. ゼブラフィッシュ胚心臓心筋(緑)と血球(マゼンタ)の可視化像。B. 心房と心室の境界部
に房室弁が形成される。房室弁は3層構造の管腔側に位置する心内膜からなる。C. 上部房室
弁の早期形成過程。受精後2日から房室弁領域に位置する心内膜細胞が間質側に向かって移
動を開始し、折りたたまれた構造が形成される。その後、細胞間の接着が弱まることでリーフ
レット構造となり、血液を正常に送りだす機能的な弁が形成される(上図)。この形成過程に
限定して、Ca2+流入が弁領域で強く認められる(下図)。
多様な局面で作用する生理的な「力」の働きを知ることは容易くないですが、私たちはユニークな力操作法を開発することで直接的な力作用を捉え、力学応答機構の理解を深めることを目指しています。これまで、ゲル素材ビーズを心臓管腔内に留める外科的手技を確立しました。ここで挿入されたビーズは拍動と血流を妨げることなく心拍動にあわせて管腔内で運動します。異所性の力発生がイメージング結果を基にした力学値シミュレーションから算出でき、心管腔を構成する心内膜では、ビーズの動きに依存した力学応答シグナルが観察できます。
さらなる検討として、力学的操作性に優れ、生体組織への影響が低く、かつ組織透過性が高い磁力に着目しています。新たに磁気ピンセット法を実装して、心臓管腔内に留置した磁気ビーズを胚体外から引っ張ることで定量可能な「力」を人為的に発生させる手技の開発に成功してきました。現在は異なる特性をもつ磁性体の活用や、磁気遺伝学の実現を目指し、磁力による分子―細胞―組織レベルの多階層生体機能操作と力学作用の検証に取り組んでいます。
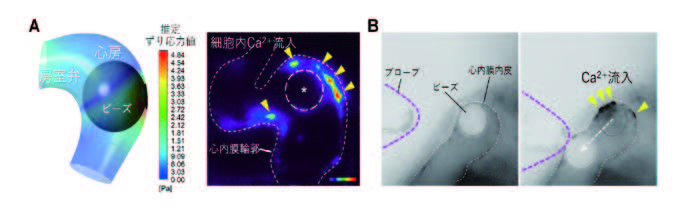
図2.個体内において力を操作する手法
A. 拍動と挿入したビーズの動きを基にした心房管腔内で発生する力のシミュレーションでは、
心房拡張期から収縮が開始するとビーズが移動し、ビーズが近接する領域で異所的な強いず
り応力が発生する(左図)。また、実際に力の発生に依存して力学シグナル活性がみられる(右
図)。B. ゼブラフィッシュ個体への磁気ピンセット法の応用。胚体外の磁気プローブを操作する
ことで、心管腔内に留置した磁気ビーズ移動に伴う力が発生する。発生する力に直接依存して
細胞内Ca2+ 流入(黄色矢頭)が誘導できる。
Copyright©2019 Institute of Advanced Medical Sciences, Tokushima University