発生生物学分野

2005年 大阪大学大学院理学研究科 博士後期課程修了
2005年 大阪大学大学院生命機能研究科 特任助手
2008年 大阪大学大学院生命機能研究科 助教
2013年 徳島大学藤井節郎記念医科学センター 初期発生研究分野 助教
2017年 徳島大学先端酵素学研究所 教授
研究概要
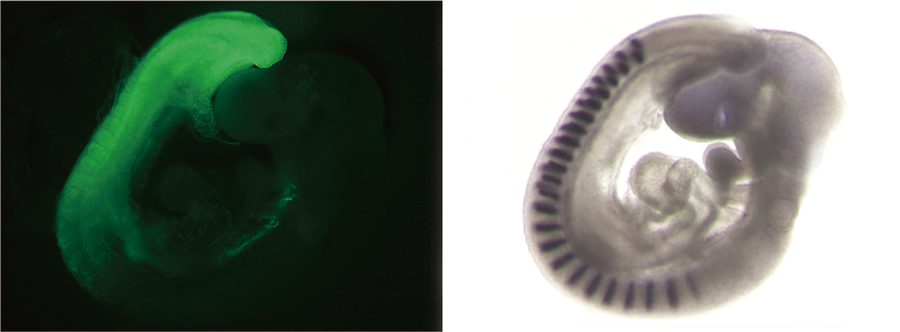
脊椎動物の初期の発生において最初に形成されるのが頭部の組織です。そののち、体幹部の組織が発生の進行とともに頸部から尾部にむかい段階的に形成されます。マウスの胚においては、妊娠7~8日目において頭部の組織が形成され、つづいて、体幹部(および、尾部)の組織が約5日(妊娠8~13日目)をかけて形成されます。この時期の胚では、神経管を中心として側方に体節中胚葉、中間中胚葉、側板中胚葉が形成されます。また、神経管の腹側には脊索および内胚葉が形成されます。こういった体幹部および尾部の段階的な形成は脊椎動物で保存されています。このように、体幹部の組織が頸部から尾部にかけて段階的に付加されながら形成される過程を体軸伸長とよびます。体軸伸長において、体幹部や尾部の組織は原腸陥入の場である原条とその周辺のエピブラスト(胚盤葉上層)あるいは尾芽から供給される細胞により形成されます。私たちは、原腸陥入期にエピブラスト(胚盤葉上層=すべての体細胞の前駆体)から多様な体細胞系列が産み出される仕組みを研究しています。
図は、将来の体幹部・尾部の胚組織で蛍光タンパクを発現する遺伝子改変マウス。私たちは、体軸幹細胞の制御に関与する遺伝子の機能を欠失させることや、体軸幹細胞から産み出される細胞系列を標識することで解析を進めています。
また、高岡グループでは、発生休止の研究を行っています。
https://researchmap.jp/takaoka.katsuyoshi
最近の主要論文
- Hayashi S, Suzuki H, Takemoto T.
Wnt3a is an early regulator of the Wolffian duct directionality via the regulation of apicobasal cell polarity
Dev Biol. 522: 136-142 (2025) - Kondoh H. and Takemoto T.
The origin and regulation of Neuromesodermal progenitors (NMPs) in embryos
Cells 13 (6): 549 (2024) - Saito S, Kanazawa U, Tatsumi A, Iida A, Takemoto T, Suzuki T.
Functional analysis of a first hindlimb positioning enhancer via Gdf11 expression
Front. Cell Dev. Biol. 12: 1302141 (2024) - Chen YC, Saito D, Suzuki T, Takemoto T.
An inducible germ cell ablation chicken model for high-grade germline chimeras.
Development. 150(18): dev202079 (2023) - Hatakeyama Y, Saito N, Mii Y, Takada R, Shinozuka T, Takemoto T, Naoki H, Takada S. Intercellular exchange of Wnt ligands reduces cell population heterogeneity during embryogenesis.
Nat Commun. 14(1):1924 (2023) - Hayashi S, Suzuki H, Takemoto T.
The nephric mesenchyme lineage of intermediate mesoderm is derived from Tbx6-expressing derivatives of neuro-mesodermal progenitors via BMP-dependent Osr1 function.
Dev Biol. 478: 155-162 (2021)