免疫アレルギー学分野

1994年 東京医科歯科大学大学院博士課程修了 医学博士
1995年 セントジュード小児研究病院 博士研究員
2003年 東京医科歯科大学大学院免疫アレルギー学 准教授
2012年 徳島大学疾患プロテオゲノム研究センター 教授
2016年 徳島大学先端酵素学研究所 教授
研究概要
臨床的に重要な疾患(=罹患率 and/or 死亡率の高い疾患)の多くは、遺伝要因と環境要因の両者が関与して発症することが明らかになってきています。その遺伝要因の解明には、全ゲノム中の1塩基の突然変異が原因で発症する単一遺伝子病の研究が大きな貢献を果たしてきました。私たちは、小児科医として患者さんを診療する中で、高IgE症候群という興味深い臨床症状を呈する患者さんを見いだし、その病因・病態の解明、新規治療法開発を目的として研究を開始しました。
高IgE症候群の病因の解明
高IgE症候群はアトピー性皮膚炎、高IgE血症、骨粗鬆症、黄色ブドウ球菌による皮膚膿瘍と肺炎、真菌感染症、脊椎側弯症などのさまざまの臨床症状を呈する遺伝性難病です。比較的頻度の高い疾患であるにもかかわらず、その原因は40年以上に渡り不明で、そのため治療法も対症療法以外ありませんでした。
私たちは、高IgE症候群症例のサイトカインのシグナル伝達を検討し、常染色体劣性遺伝の高IgE症候群においてはチロシンキナーゼTYK2のナンセンス変異が、常染色体優性遺伝の高IgE症候群においては転写因子STAT3の片アレルのドミナントネガティブ変異がその原因であることを明らかにしました。しかし約3分の1の高IgE症候群の原因は現在でも不明で、次世代シークエンサーを用いてその病因を解明していきます。
高IgE症候群の病態の解明
高IgE症候群の原因遺伝子が明らかになっても、STAT3分子は50以上のシグナル伝達経路に関与しているため、どのようにして高IgE血症、アトピー性皮膚炎、黄色ブドウ球菌感染症、骨粗鬆症を起こすかは判りませんでした。そこで患者由来細胞を用いて、病態形成メカニズムを検討し、黄色ブドウ球菌感染症が皮膚と肺に限局して発症するのは、T細胞のTh17細胞分化障害が存在し、上皮細胞がIL-17依存性にβ-defensin等の黄色ブドウ球菌を排除する物質を産生するためであることを見いだしました。さらに、アトピーの発症には、樹状細胞におけるIL-10のシグナル伝達障害とそれによる誘導性制御性T細胞(iTreg cell)の分化障害が関与していることを明らかにしました。
現在はSTAT3のドミナントネガティブ変異体を全身に発現する高IgE症候群のモデルマウスの樹立し、このマウスを詳細に検討して病態解明を加速しています。
アトピーに対する新規治療法の開発
ヒト血液中のIgE量は、アトピー性疾患の発症率と強い相関を示します。すなわち、血清IgE値が高いほどアトピー性疾患の発症率が高くなります。さらに、血清IgEを中和抗体(omalizumab;ゾレア®)で低下させることにより、ほとんどのアトピー性疾患の臨床症状は改善しますが、この中和抗体は非常に高価なため、既存治療に抵抗性の重症気管支喘息以外では適応となっていません。そこでヒト高IgE症候群の高IgE血症のメカニズムを明らかにすることから、血清IgEの新たな制御法を見いだすことを目指して研究を展開しています。
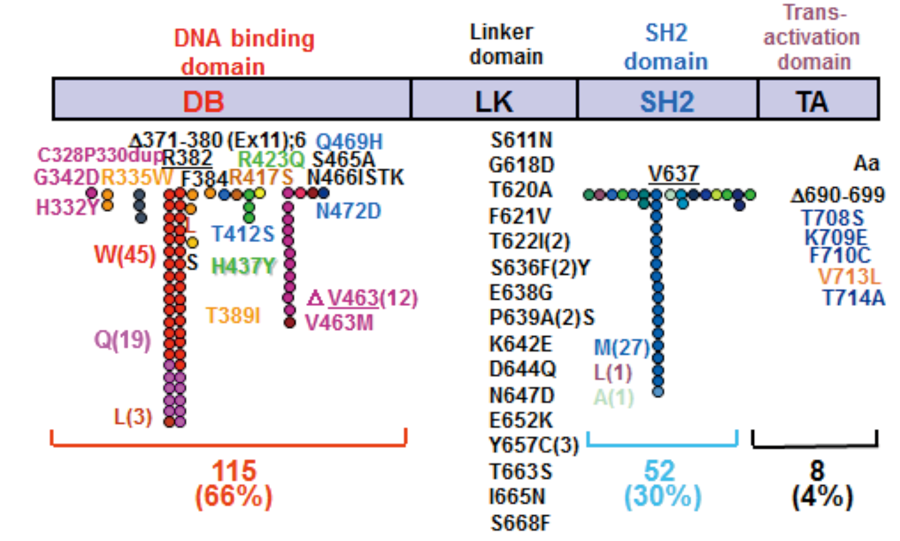
高IgE症候群の原因遺伝子変異
180家系の高IgE症候群症例から同定されたSTAT3の遺伝子変異。突然変異はSTAT3のDNA結合領域(DB)とSH2領域に集中し、1アミノ酸置換またはフレームシフトを伴わない小さなアミノ酸欠失である。コドン382のアルギニン(R382),コドン463のバリン(V463)、コドン637のバリン(V637)が突然変異のホットスポットで全体の半数以上を占め、残りは40種類以上の多様な変異である。
最近の主要論文
- Ma CS, Wong N, Rao G, Nguyen A, Avery DT, Payne K, Torpy J, O’Young P, Deenick E, Bustamante J, Puel A, Okada S, Kobayashi M, Martinez-Barricarte R, Elliott M, Sebnem Kilic S, El Baghdadi J, Minegishi Y, Bousfiha A, Robertson N, Hambleton S, Arkwright PD, French M, Blincoe AK, Hsu P, Campbell DE, Stormon MO, Wong M, Adelstein S, Fulcher DA, Cook MC, Stepensky P, Boztug K, Beier R, Ikincioğullari A, Ziegler JB, Gray P, Picard C, Boisson-Dupuis S, Phan TG, Grimbacher B, Warnatz K, Holland SM, Uzel G, Casanova JL, Tangye SG.
Unique and shared signaling pathways co-operate to regulate the differentiation of human CD4+T cells into distinct effector subsets.
J Exp Med. 213: 1589-1608 (2016) - Kreins AY, Ciancanelli MJ, Okada S, Kong XF, Ramírez-Alejo N, Kilic SS, El Baghdadi J, Nonoyama S, Mahdaviani SA, Ailal F, Bousfiha A, Mansouri D, Nievas E, Ma CS, Rao G, Bernasconi A, Sun Kuehn H, Niemela J, Stoddard J, Deveau P, Cobat A, El Azbaoui S, Sabri A, Lim CK, Sundin M, Avery DT, Halwani R, Grant AV, Boisson B, Bogunovic D, Itan Y, Moncada-Velez M, Martinez-Barricarte R, Migaud M, Deswarte C, Alsina L, Kotlarz D, Klein C, Muller-Fleckenstein I, Fleckenstein B, Cormier-Daire V, Rose-John S, Picard C, Hammarstrom L, Puel A, Al-Muhsen S, Abel L, Chaussabel D, Rosenzweig SD, Minegishi Y, Tangye SG, Bustamante J, Casanova JL, Boisson-Dupuis S.
Mucobacterial and viral infections without hyper-IgE syndrome. Human TYK2 deficiency
J Exp Med. 212: 1641-1662 (2015) - Egawa M, Mukai K, Yoshikawa S, Iki M, Mukaida N, Kawano Y, Minegishi Y, Karasuyama H.
Inflammatory monocytes recruited to allergen-exposed skin acquire an anti-inflammatory property via basophil-derived IL-4.
Immunity. 38: 570-580 (2013) - Saito M, Nagasawa M, Takada H, Hara T, Tsuchiya S, Agematsu K, Yamada M, Nonoyama S, Karasuyama H, Minegishi Y.
Defective IL-10 signaling in hyper-IgE syndrome results in impaired generation of tolerogenic dendritic cells and induced regulatory T cells.
J Exp Med. 208: 235-249 (2011) - Minegishi Y, Saito M, Tsuchiya et al.,
Dominant-negative mutations in the DNA-binding domain of STAT3 cause hyper-IgE syndrome.
Nature. 448, 1058-1062, 2007