分子生命科学分野

2011年 北海道大学大学院生命科学院 博士課程修了,博士 (生命科学)
2011年 Postdoctoral Fellow, Chemistry & Chemical biology, Rutgers University
2014年 北海道大学大学院理学研究院 助教
2020年 徳島大学先端酵素学研究所 教授
研究概要
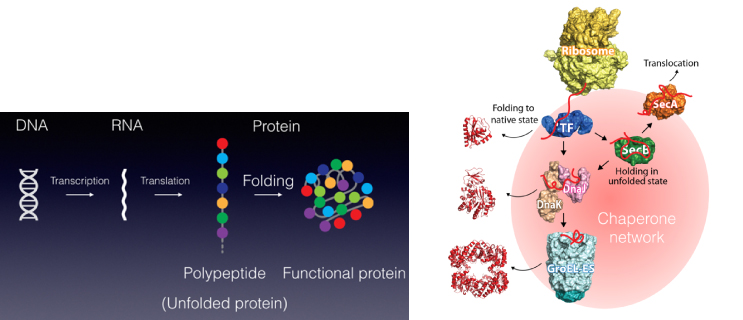
私たちは,生体内のシャペロンネットワークに着目し,細胞内タンパク質の恒常性維持のメカニズムを分子レベルから明らかにすることを目指しています.シャペロンは,タンパク質のフォールディング制御だけではなく,タンパク質輸送・分解,または酵素の活性制御や液-液相分離タンパク質の制御など,様々な機能を持ちます.私たちの研究では,核磁気共鳴 (NMR) 法やクライオ電子顕微鏡を用いた構造解析,生化学実験,ツール開発,などを行なっています.
タンパク質フォールディングと分子シャペロン −タンパク質社会の医療システム−
私たちが健康な生活を送るために病院や医療システムがあるように,細胞内のタンパク質が正しく機能するためには分子シャペロンが必須です.さらに,疾患ごとの専門医がいるように,シャペロンにもそれぞれの “専門” があり,複数のシャペロンがそれぞれ固有の機能を発揮することによって,新生タンパク質のフォールディング補助,失活した不良タンパク質の “治療” (再フォールディング) または分解などが行われます.翻訳されたタンパク質の大部分がシャペロンとの相互作用を介して成熟していき,シャペロン分子なしに細胞は生きていくことができません. また,ガン細胞においてはシャペロンの発現量が異常に高まっていたり,反対にシャペロンの機能不全がアルツハイマー病,ALSなどの神経難病の要因となったりと,シャペロンは疾病との関連も深い生体分子の一つです.私たちは,このように多彩な機能を持つシャペロンに注目し,シャペロンがどうやって機能しているのか,そのメカニズムを分子レベルから解明することを目指した研究をしています.
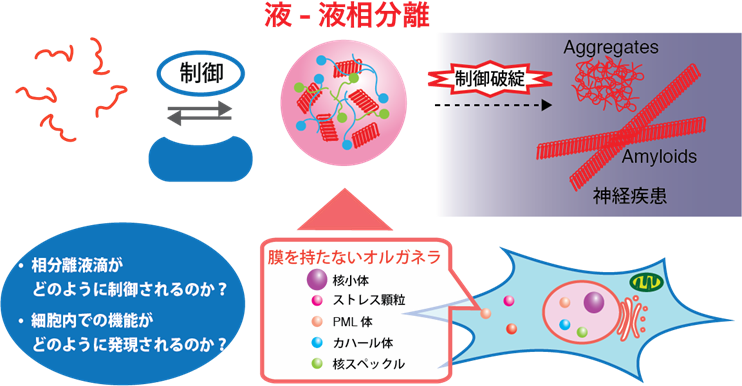
液-液相分離制御のメカニズム −これまで知られていなかったタンパク質の “状態” 制御−
最新の研究によって,細胞内のタンパク質が,不均一な状態であることが明らかになってきています.細胞膜で囲われていなくても,タンパク質の多量体形成を核とした「液-液相分離」によって,区分された液滴領域が形成され,生体反応の”場”が形成されます.この,液-液相分離現象は,私たちの身近なところでは,ドレッシングの油滴などにおいてみられますが,このような現象が,私たちの細胞の中でも起きているのです.液-液相分離は,分子レベルでの現象と,細胞レベルでの機能をつなぐ概念としても注目されていますが,そればかりではなく,液-液相分離という概念は,筋萎縮性側索硬化症 (ALS)や認知症,アルツハイマー病などの神経疾患に対する研究を大きく変えようとしています.従来のアミロイド仮説に加え,液-液相分離の制御破綻と神経疾患の関連が強く示唆されています.私たちは,「相分離の制御と破綻」に注目し,特に相分離の制御因子に対する研究を推進しています.相分離制御因子についての立体構造解析から,相分離という状態がどのように制御されているのかを分子レベルで明らかにするとともに,制御破綻によって疾病が発症するメカニズムを理解します.
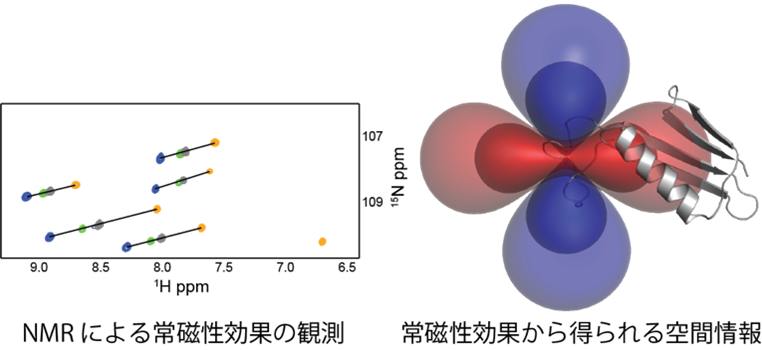
タンパク質の動的構造解析法 −新しい計測法から見えてくるタンパク質の本来の姿−
生命における ”分子機械” として,タンパク質はそれぞれ特徴的な立体構造を有し, さらにそれをダイナミックに変化させることによって機能を発揮します. しかし,その構造変化がどの段階で, どのようなタイムスケールで起こるのか, といったタンパク質の “動き” に関する理解はほとんど進んでいません. 私たちは,NMRや常磁性ランタノイドイオンなどを用いた戦略によって,タンパク質の立体構造変化を追跡する手法の開発に取り組んでいます.
最近の主要論文
- Kawagoe S, Matsusaki M, Mabuchi Y, Ogasawara Y, Watanabe K, Ishimori K, *Saio T. Mechanistic Insights Into Oxidative Response of Heat Shock Factor 1 Condensates. JACS Au, 5, 606–617, 2025.
- Kawamukai H, Takishita S, Shimizu K, Kohda D, Ishimori K, *Saio T. Conformational Distribution of a Multidomain Protein Measured by Single-Pair Small-Angle X-ray Scattering. J Phys Chem Lett, 15, 744-750, 2024.
- Kawagoe S, Kumashiro M, Mabuchi T, Kumeta H, Ishimori K, Saio T. Heat-Induced Conformational Transition Mechanism of Heat Shock Factor 1 Investigated by Tryptophan Probe.
Biochemistry, 64, 24, 2897, 2022. - Nanaura H., Kawamukai H., Fujiwara A., Uehara T., Aiba Y., Nakanishi M., Shiota T., Hibino M., Wiriyasermkul P., Kikuchi S., Nagata R., Matsubayashi M., Shinkai Y., Niwa T., Mannen T., Morikawa N., Iguchi N., Kiriyama T., Morishima K., Inoue R., Sugiyama M., Oda T., Kodera N., Toma-Fukai S., Sato M., Taguchi H., Nagamori S., Shoji O., Ishimori K., Matsumura H., Sugie K., *Saio T. , *Yoshizawa T., *Mori E. C9orf72-derived arginine-rich poly-dipeptides impede phase modifiers. Nat Commun. 12, 5301, 2021.
- *Saio T. , Hiramatsu S., Asada M., Nakagawa H., Shimizu K., Kumeta H., Nakamura T., *Ishimori K. Conformational ensemble of a multidomain protein explored by Gd3+ electron paramagnetic resonance. Biophys J., 120, 2943-2951, 2021.