2022年 徳島大学先端酵素学研究所 蛋白質発現分野 技術補佐員
2024年 現職


サイト内検索

1990年 徳島大学大学院薬学研究科 博士後期課程修了、薬学博士
1990年 徳島大学薬学部 助手
1993年 徳島大学薬学部 助教授
2002年 ゲノム機能研究センター 教授、薬学部教授を兼務
2016年 徳島大学先端酵素学研究所教授、薬学部教授を兼務
ミトコンドリアは細胞内でエネルギー変換の場として働いているだけでなく、細胞の生死の制御にも関わっていることが明らかにされてきました。従って、ミトコンドリアは多くの疾病の発症と密接に関わっていると考えられ、ミトコンドリアの機能を人為的に制御することができれば、新たな疾病治療法の確立に繋がる可能性を秘めています。私どもの研究室では主としていくつかのミトコンドリアのタンパク質の構造と機能の理解を通じて、ミトコンドリアの構造と機能の理解を深めることを目指しています。
このタンパク質の研究の歴史は古く、一次構造が明らかにされた最初の輸送タンパク質としても知られています。このタンパク質の研究が飛躍的に進んだ理由として、親和性が極めて高い(それぞれのKdはおよそ10-9 M)カルボキシアトラクチロシドとボンクレキン酸という2つの阻害剤が発見されたことがあげられます。これらの化合物はそれぞれミトコンドリア内膜の外側と内側からADP/ATP輸送体に結合して輸送活性を阻害することが知られています。カルボキシアトラクチロシドの結合したADP/ATP輸送体の結晶構造は2003年に報告されましたが、ボンクレキン酸の結合したADP/ATP輸送体の結晶化は長らく成功せず(後述の通り、2019年の初めに報告された)、ボンクレキン酸がどのようにADP/ATP輸送体と相互作用しているのか、明らかにされておりませんでした。我々の研究室ではミトコンドリアのタンパク質の復帰変異株を効率よく獲得する実験系の確立に成功しましたので(山越ら、Mitochondrion、2017年)、この実験系を使ってボンクレキン酸存在下でも輸送活性を示す変異株を取得することができれば、ボンクレキン酸と相互作用しているADP/ATP輸送体のアミノ酸残基の同定が可能であると考えて研究を進め、L142、I200、S245、G298の各残基が相互作用していることを明らかにしました(問山ら、2019年)。
これらの知見の妥当性は、英国MRCのKunji博士らがボンクレキン酸の結合したADP/ATP輸送体の結晶構造を報告し(Ruprechtら、Cell、2019年)、確認することができました(図1参照)。現在、①復帰変異株獲得法をファインチューニングすることによって、変異株獲得効率の更なる向上を目指す、②ボンクレキン酸と相互作用しているアミノ酸残基のボンクレキン酸との相互作用の強度を正確に評価する実験系の確立、③ボンクレキン酸誘導体の作用の評価(九大先導研の新藤 充教授との共同研究)などの研究課題を推進中です。また、弱いATPアナログとしての活性を有する化合物として知られてきたsuraminという化合物や少し親和性の低下したボンクレキン酸誘導体はADP/ATP輸送体を膜の両サイドから阻害することを明らかにすることができました1,2)。
我々の研究室では褐色脂肪組織の熱産生を可能にしているタンパク質の同定を目指してトランスクリプトーム解析を進め、筋型カルニチンパルミトイル基転移酵素CPT1b、筋型脂肪酸結合タンパク質FABP3、およびミオグロビンが重要であることを報告してきました。現在、これらのタンパク質に加え、脱共役タンパク質UCP1や2型カルニチンパルミトイル基転移酵素CPT2などの構造と機能、生理的役割の理解に向けた研究に着手しています3)。
また、当研究室の出身で、2019年の11月まで研究室のスタッフとして活躍してきた山本武範博士(現在、国立医薬品食品衛生研究所遺伝子医薬部の室長)、旧スタッフの廣島佑香博士(現在本学歯学部)、伊藤 剛博士(現在愛媛大学農学部)との共同研究も進行中です4-6)。
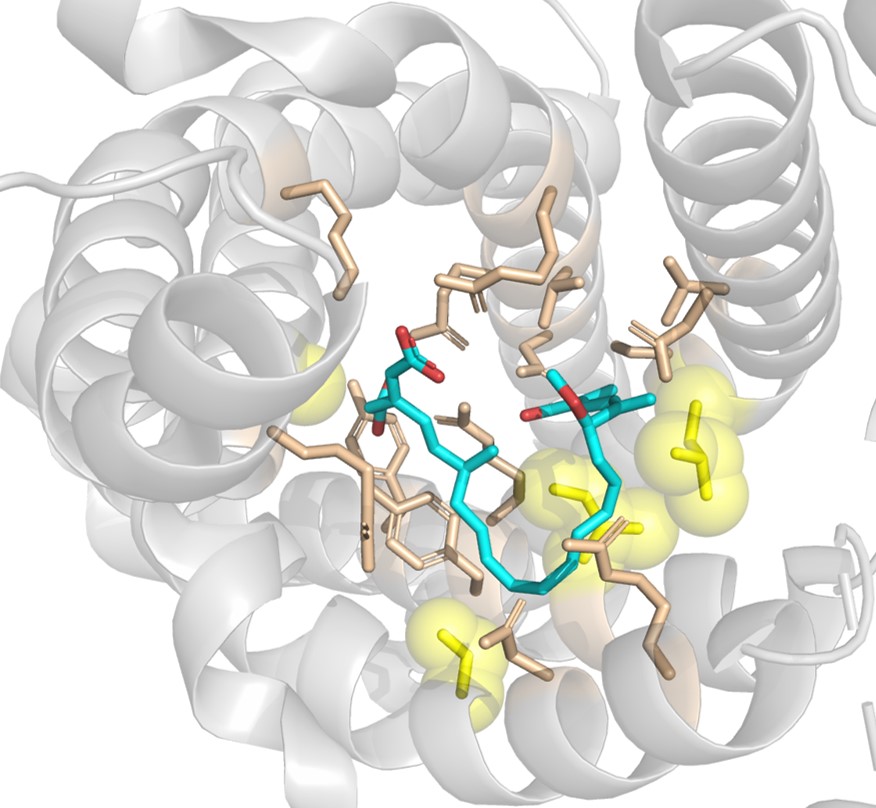
図1.ボンクレキン酸と相互作用しているADP/ATP輸送体のアミノ酸残基
ボンクレキン酸(炭素骨格=青、酸素原子=赤)と相互作用しているアミノ酸残基をstickで示し、そのうち我々が復帰変異株の獲得によって同定していた4つのアミノ酸残基を黄色で示した。原著論文はRuprechtら、Cell 176(2019)435。
Copyright©2019 Institute of Advanced Medical Sciences, Tokushima University