三宅雅人先生 インタビュー
沢津橋:令和4年度 「革新的先端研究開発支援事業AMED-PRIME」の採択おめでとうございます。研究開発領域「プロテオスタシスの理解と革新的医療の創出」、プロテオスタシス研究開発領域での採択と伺っています。参考1
早速ですが、今回採択されたテーマについて簡単に説明して頂けますか?
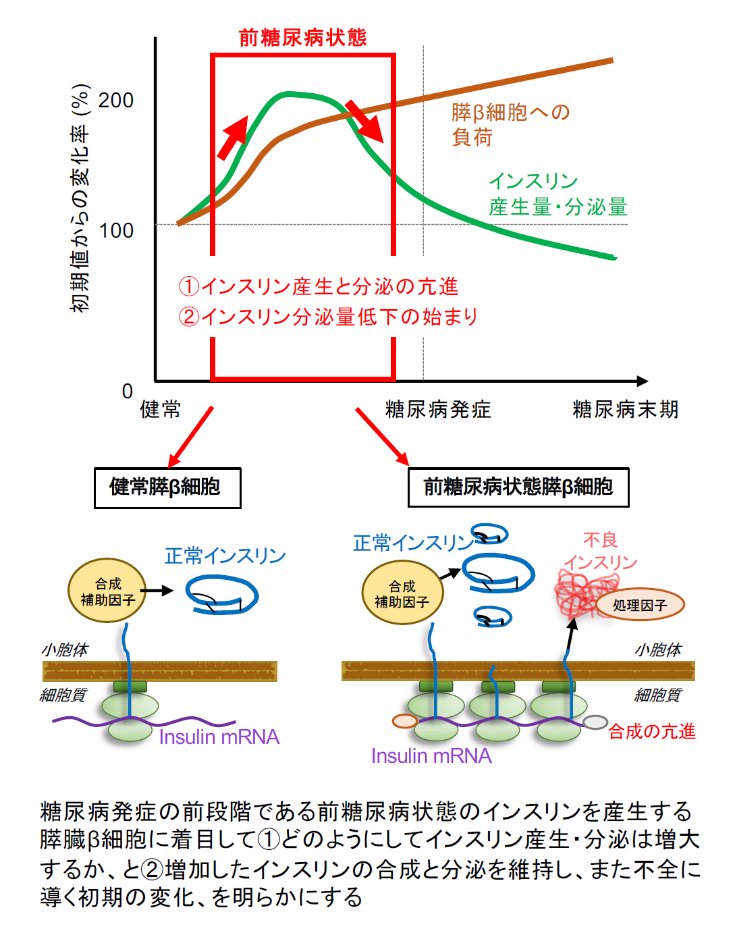
三宅:血糖降下作用をもつホルモンであるインスリンを産生している膵臓のβ細胞(膵β細胞)のタンパク質恒常性をキーワードに、2型糖尿病の発症までにインスリン産生がどうやって増大するか、さらにインスリン産生がどのようにして細胞のストレスを引き起こすか、を明らかにすることが研究のテーマです。

沢津橋:本研究課題の特徴を教えてください。
三宅:背景として、2型糖尿病では脂肪・骨格筋などの末梢臓器でインスリンが効きにくくなったインスリン抵抗性となります。そのため膵β細胞は、インスリンをたくさん合成して分泌するようになり、結果として膵β細胞が疲弊し、インスリン分泌量が低下してしまいます。これまでの研究では、2型糖尿病の発症の前後で、例えばあるタンパク質の発現量が変動しているので、このタンパク質は重要であろう、といった研究が主流で、こういった研究は病態を理解するうえでとても重要でした。
三宅:今回採択された研究では、糖尿病の発症前に膵β細胞がインスリン産生を頑張っている状態から機能が低下する一番変化の大きい時期でタンパク質恒常性がどう変化するか?に着目した点が評価されたと思います。
沢津橋:先ほどの『膵β細胞が疲弊する』前後で、タンパク質恒常性がどう変わってしまうのかということですね。いわゆる糖尿病の未病という状態の診断に繋がるような研究でしょうか?
三宅:そうですね。そのような診断にまで繋げることができれば良いと思います。すでに血中マーカーでそのような糖尿病の未病を診断するような研究は進んでいるので、膵β細胞内でどのような分子的な変化が起きているかを解明することで、将来的に診断に繋げられたら良いなと思っています。
沢津橋:研究開発領域名にもあるプロテオスタシス(タンパク質恒常性)とはどういった現象をターゲットにしているのでしょうか?
三宅:本研究課題では膵β細胞内のタンパク質恒常性、特にインスリンの合成がターゲットです。1つ目の課題では、mRNAからタンパク質への合成ステップである翻訳に着目しています。インスリンmRNAの合成だけではなく翻訳が強力に活性化されるメカニズムを解明したいと思います。また同時に、インスリンの分泌を助けるタンパク質も翻訳が活性化されるだろうと予想しているので、こういったインスリンとその分泌を助けるタンパク質たちがどういったメカニズムで翻訳制御されるのかを明らかにしていきたいですね。
沢津橋:ここでターゲットとしている分泌を助けるタンパク質とは、何でしょうか?リボソームなどの翻訳装置や分泌促進タンパク質、分子シャペロンなどフォールディングを助けるような分子でしょうか。
三宅:そうですね、そのようなタンパク質がターゲットです。フォールディングについては、2つ目の課題でも関連しています。2つ目の課題としてインスリンが過剰に産生されたときの膵β細胞でのインスリン分子の相互作用の変化を通してインスリンのフォールディング維持機構に迫りたいと考えています。
沢津橋:仮説としては、どういったことを考えていますか?またこの研究課題で一番明らかにしたいことは何ですか?
三宅:1つ目の課題としてこれまでに栄養成分のうちアミノ酸によって翻訳がコントロールされることは、よく知られています。一方で、グルコースによる翻訳制御については分かっていないことがより多くあると思います。グルコースによって細胞内のエネルギーが増加したから、翻訳が活性化するのではないかと単純に考えられていますが、私はより選択的な翻訳制御が存在するのではないかという仮説を立てています。この選択的な翻訳制御には、糖で活性化する酵素や糖代謝物が関わるのではないかと考え、まずは翻訳の変化を網羅的に調べてみたいと思います。
三宅:2つ目の課題としてはインスリンの正常な合成を助ける分子は多く知られていますが、過剰にインスリンを産生したときに発揮される重要な機構があると考えており、独自の系を用いることで、そのような機構の鍵分子を同定したいと思います。
沢津橋:翻訳の活性化をコントロールするシグナル経路を解明するということですね。では、本研究課題でカギとなる技術は何でしょうか?
三宅:今回の研究では、同研究所・細胞情報学分野参考2の吉川先生の確立したリボソームの分離技術を利用します。この技術はHPLCを使ってリボソームタンパクの複合体を単離・分析する技術参考3なのですが、この技術を使って、グルコースの刺激下でリボソームプロファイリングができると考えています。
沢津橋:グルコースに応答する翻訳中のリボソームの違いに着目するということですね。
三宅:そうですね。翻訳中のmRNAの種類をみれば、標的の遺伝子が分かると考えています。学内の研究クラスター・特殊化リボソームとしても吉川先生とは共同研究を進めています。また翻訳装置や相互作用分子のプロテオーム解析については、同研究所・細胞情報学分野参考2の小迫先生と共同研究で進める予定です。
沢津橋:研究所内のコラボレーションですね、素晴らしい。リボソームプロファイリングという技術については、今後吉川先生にもインタビューをお願いして詳しく紹介してもらいます。

三宅先生(左)、吉川先生(右)、共同利用機器HPLC/UHPLCシステム(左、Thermo社Vanquish)
沢津橋:テーマのお話から少し外れて、研究者としてどのような経験から、この研究始めるに至ったのか、その経緯を教えてください。
三宅:私はもともと農学部の出身で、家畜を使って細胞分化や代謝の細胞生物学的な研究をしていました。さらに分子生物学的な研究を始めたくて、徳島大学に移ってきました。徳島に移ってもう10年以上経ちますね。
徳島大学に来てからは、膵β細胞とインスリン標的臓器を中心に、小胞体ストレスと糖尿病・代謝疾患の研究を行ってきました。最近では統合的ストレス応答に注目していて、そこから今回の膵β細胞の翻訳制御を研究課題とした経緯があります。統合的ストレス応答は1つ目の翻訳制御に、小胞体ストレス応答は2つ目のフォールディングのテーマに関連しています。
沢津橋:膵β細胞の専門家ということですね。今度は少し技術に関して教えてください。先端酵素学研究所には共用機器やオープンラボが整備されている参考4のですが、研究所内の共同利用機器のうち、本課題で活躍する装置があれば教えてください。
三宅:ハイコンテンツアナライザーやオールインワン顕微鏡、セルソーター、リボソームプロファイリングで使用するHPLCシステムなどですね。共通機器は本当に充実していますよね。

共同利用機器ハイコンテンツ共焦点イメージングシステム (パーキンエルマー社Operetta CLS System)
共同利用機器オールインワン蛍光顕微鏡 (キーエンス社BZ-X800)
沢津橋:細胞を見る、分けるための装置を主に利用されているのですね。素晴らしい結果が生まれることお祈りしています。また所内のコラボレーションもうまくいくといいですね。本日はどうもありがとうございました。
参考1:https://www.amed.go.jp/koubo/16/02/1602C_00011.html
https://www.amed.go.jp/content/000108227.pdf
参考2:先端酵素学研究所・細胞情報学分野 https://www.iams.tokushima-u.ac.jp/wpsite/lab/kosako/
参考3:文献情報 https://pubmed.ncbi.nlm.nih.gov/34458400/
参考4:学内の方で、先端酵素学研究所内に整備された共同利用機器を利用したい方はこちら